Hanoi, (VNA)- ElConsejo Nacional de Ética en Investigación Biomédica (CNEIB), del Ministerio de Salud de Vietnam, acordó el uso delos resultados de la investigación de ensayos clínicos hasta la fecha de la vacunaNano Covax, para considerar la concesión pronta de un registro para su circulacióncondicional al servicio de las labores preventivas contra el COVID-19.
En un comunicadoemitido hoy al respecto, la misma entidad informó que esos resultados deben serenviados al Consejo Consultivo para el registro de medicamentos e ingredientes medicinales para que esa entidad evalúe esteasunto.
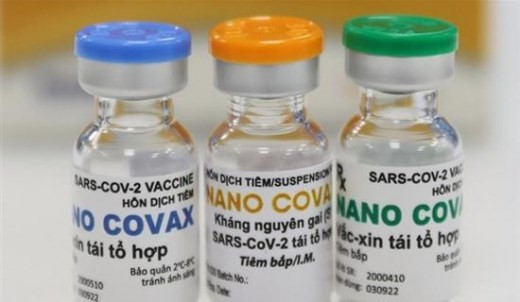
Nano Covax, producidapor la empresa vietnamita Nanogen, cumple con los requisitos de seguridad segúnel informe del ensayo clínico a mediano plazo de la tercera fase hasta la fecha, señala el texto.
También se refirió a susconclusiones dadas en una reunión reciente sobre el resultado del ensayo clínicoen la tercera fase de Nano Covax hasta el 18 de agosto pasado, en las cuales enfatizóque dicho fármaco tiene inmunogenicidad en las pruebas.
Sin embargo, el CNEIBsolicitó que se agreguen los resultados de la prueba de neutralización delvirus SARS-CoV-2 en cultivo de células vivas en las cepas Delta y Alpha para cumplircon los estándares según el plan aprobado.
Por otro lado, instó ala empresa de biotecnología farmacéutica Nanogen y al equipo deinvestigación a completar el informe sobre la actualización de los resultados de la investigación de ensayos de ese medicamento.
Según el CNEIB, en elcaso de que la vacuna Nanocovax obtenga una licencia de comercialización, estefármaco solo se puede usarse condicionalmente de acuerdo con la cantidad y elplan aprobados por el Ministerio de Salud, y las personas que usan esta vacunadeben ser monitoreadas estrictamente sobre el estado de salud.
En la actualidad, nohay datos para evaluar directamente la eficacia protectora de la vacuna Nanocovax,aclaró el comunicado mencionado, y agregó que es necesario continuar evaluando elefecto protector de ese medicamento según el protocolo aprobado./.